2022年5月26日,国际期刊《德国应用化学》(Angewandte Chemie International Edition)在线刊发了化学与化工学院、生物无机化学与药物湖北省重点实验室钟芳锐教授和廖荣臻教授的最新合作研究成果“不对称催化构建C-N轴手性氨基吲哚”(Catalytic Atroposelective Electrophilic Amination of Indoles, DOI: 10.1002/anie.202205159)。该论文发展了一种醌二亚胺与吲哚的阻转选择性1,6-加成新反应,制备了一系列含C-N手性轴的新颖氨基吲哚类分子。理论计算研究揭示了反应的机理,细胞毒性测试发现这类吲哚衍生物具有抗肿瘤活性。
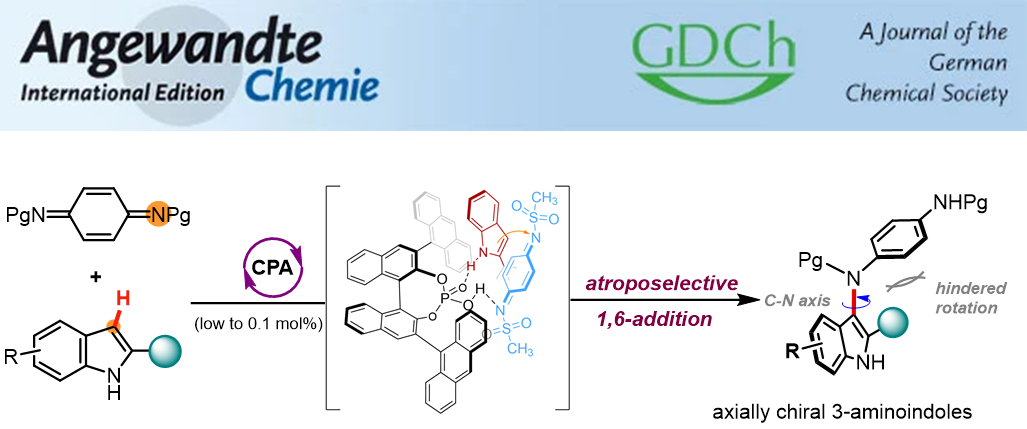
手性吲哚衍生物在天然产物合成、药物研发和材料科学等领域具有重要的用途。这类分子的现有合成研究主要集中在不对称催化傅-克烷基化和芳基化反应,用于制备相应的中心手性和C-C轴手性吲哚衍生物。相比之下,受限于较低的构型稳定性,含C-N手性轴氨基吲哚分子的制备仍是研究难题。对此,钟芳锐教授团队在前期关于醌类化合物不对称催化反应的研究基础上,发现对苯醌二亚胺在手性质子酸催化下能与吲哚发生1,6-共轭加成反应。该反应模式与醌类化合物的经典1,4-加成显著不同,醌二亚胺充当了一种高亲电性的胺化试剂,而非已知的芳基化试剂。基于这一发现,钟芳锐团队通过选择合适的手性磷酸催化剂,首次发展了阻转选择性的醌二亚胺1,6-加成反应,合成了一系列轴手性3-氨基吲哚类分子,催化剂用量低至千分之一,产物的光学纯度高达98%。
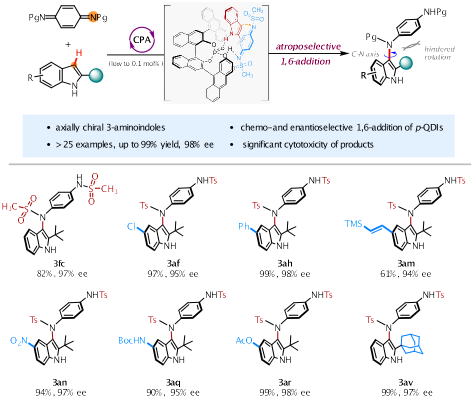
图1不对称催化构建C-N轴手性氨基吲哚衍生物
廖荣臻教授团队对该反应的机理进行了理论计算研究。结合自由基捕捉、自由基钟、EPR谱等控制实验,基于密度泛函理论模拟结果,提出上述1,6-共轭加成是通过离子型反应路径进行。此外,与1,4-加成反应的过渡态和中间体能垒及其福井指数和轨道权重福井指数对比,该反应高度专一的1.6加成选择性主要源自于醌二亚胺氮原子显著的亲电性以及过渡态和中间体较高的芳香性。
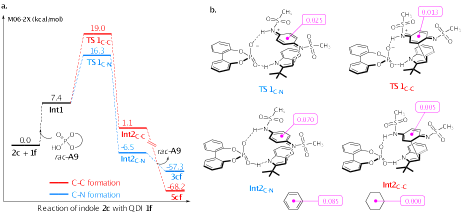
图2DFT理论计算解释反应的区域选择性
鉴于众多吲哚衍生物往往表现出显著的生物活性,研究团队还测试了所合成的轴手性3-氨基吲哚的抗肿瘤活性。实验结果显示,其中三个化合物对于Hela细胞的IC50(半抑制浓度)值达到20μM左右,在相同条件下甚至优于临床上常用的抗癌药物伊立替康(irinotecan)和氟尿嘧啶(5-fluorouracil),表明这类新颖的轴手性3-氨基吲哚衍生物在药物研发中有重要的应用前景。
我校为论文的唯一完成单位,钟芳锐教授和廖荣臻教授是论文的共同通讯作者。生物活性测试由吴钰周教授团队合作完成。该论文第一作者为化学与化工学院2018级硕士研究生秦京阳(目前在CSC奖学金资助下于德国亚琛工业大学攻读博士学位)。创新研究院2021级博士研究生周彤和化学与化工学院2019级硕士研究生周太平为论文的共同第一作者。该项工作得到了国家重点研发计划(2018YFA0903500)、国家自然科学基金(21602067)和湖北科技创新重大专项(2019ACA125)资助。